( 5分)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:
2SO2(g)+O2(g)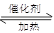 2SO3(g) 2min末测得容器中有7.2mol SO2。试回答:
2SO3(g) 2min末测得容器中有7.2mol SO2。试回答:
① 反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③ 用O2的浓度变化表示该时间段内的化学反应速率_______________________。
相关知识点
( 5分)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:
2SO2(g)+O2(g)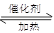 2SO3(g) 2min末测得容器中有7.2mol SO2。试回答:
2SO3(g) 2min末测得容器中有7.2mol SO2。试回答:
① 反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③ 用O2的浓度变化表示该时间段内的化学反应速率_______________________。