同素异形体相互转化的反应热相当小而且转化速度较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”来研究。已知:
①P4(s、白磷)+5O2(g)=P4O10(s);Δ H=-2983.2 KJ·mol-1
②P(s、红磷)+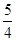 O2(g)=
O2(g)=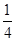 P4O10(s);Δ H=-738.5KJ·mol-1
P4O10(s);Δ H=-738.5KJ·mol-1
试写出白磷转化为红磷的热化学方程式
同素异形体相互转化的反应热相当小而且转化速度较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”来研究。已知:
①P4(s、白磷)+5O2(g)=P4O10(s);Δ H=-2983.2 KJ·mol-1
②P(s、红磷)+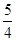 O2(g)=
O2(g)=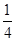 P4O10(s);Δ H=-738.5KJ·mol-1
P4O10(s);Δ H=-738.5KJ·mol-1
试写出白磷转化为红磷的热化学方程式