在一密闭体系中发生下列反应A(g)+3B(g) 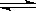 2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题: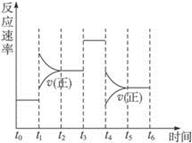
(1)t1、t3、t4时刻体系中所改变的条件可能是:__________、__________、__________;
(2)C体积分数最高的时间段是__________。(填“tx-ty”)
相关知识点
在一密闭体系中发生下列反应A(g)+3B(g) 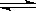 2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
(1)t1、t3、t4时刻体系中所改变的条件可能是:__________、__________、__________;
(2)C体积分数最高的时间段是__________。(填“tx-ty”)