【物质结构与性质】(15分)钙的化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为___________________.
②CaC2中C22-与O22+互为等电子体,1molO22+中含有的π键数目为_________.
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是_______________,构成丙烯腈元素中第一电离能最大的是__________.
(2)抗坏血酸钙的组成为Ca(C6H7O6)2•4H2O,其结构示意图如图1: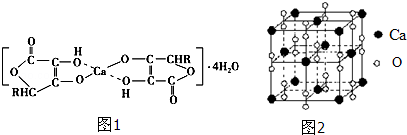
该物质中存在的化学键类型包括____________(填字母).
| A.金属键 | B.离子键 | C.非极性共价键 | D.配位键 |
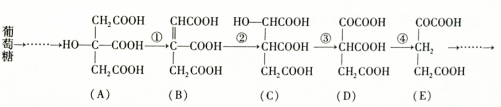
(3)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图2所示:由此可判断该钙的氧化物的化学式为____________.已知阿伏加德罗常数为NA,该晶体的密度为ρg·cm3,则晶胞中两Ca2+间的最近距离为______________cm.(用含NA、ρ的代数式表示)

 CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。
CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。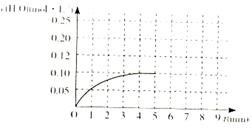
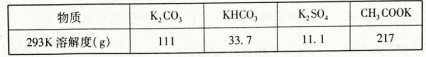
 如下表:
如下表: 
 粤公网安备 44130202000953号
粤公网安备 44130202000953号