有一包固体粉末,可能含有氧化钙、氯化钠、碳酸钠、硫酸钠中的一种或几种.为确定其组成,小杨设计出实验方案,实验步骤及现象如下.请回答:
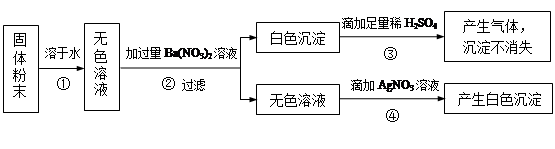
(1)写出步骤④中产生白色沉淀的化学方程式.
(2)根据实验中的现象,能否确定原固体粉末的组成?若能,请写出各成分的化学式;若不能,在原实验步骤的基础上,对上述方案中的试剂作一改进,并描述相应的实验现象及结论,以确定固体粉末的组成.
有一包固体粉末,可能含有氧化钙、氯化钠、碳酸钠、硫酸钠中的一种或几种.为确定其组成,小杨设计出实验方案,实验步骤及现象如下.请回答:
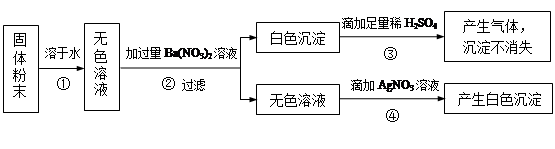
(1)写出步骤④中产生白色沉淀的化学方程式.
(2)根据实验中的现象,能否确定原固体粉末的组成?若能,请写出各成分的化学式;若不能,在原实验步骤的基础上,对上述方案中的试剂作一改进,并描述相应的实验现象及结论,以确定固体粉末的组成.