在一定温度下,容器内某一反应中M、N的物质的量n随反应时间t变化的曲线如图所示,下列表述中正确的是( ) 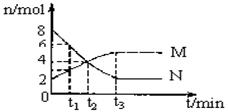
A.反应的化学方程式为2M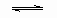 N N |
B.t2时V正=V逆 ,达到平衡 |
| C.t3时V正>V逆 | D.t1时浓度C(N)=2C(M) |
相关知识点
在一定温度下,容器内某一反应中M、N的物质的量n随反应时间t变化的曲线如图所示,下列表述中正确的是( ) 
A.反应的化学方程式为2M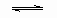 N N |
B.t2时V正=V逆 ,达到平衡 |
| C.t3时V正>V逆 | D.t1时浓度C(N)=2C(M) |