已知卤代烃(R-X)在碱性条件下可水解得到醇(R-OH),如:CH3CH2-X+H2O 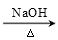 CH3CH2-OH+HR,现有如下转化关系:
CH3CH2-OH+HR,现有如下转化关系: 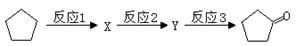
回答下列问题:
(1)反应1的试剂与条件为 __________,X的结构简式为______,Y的结构简式为______;
(2)写出反应3的方程式___________________________________。
已知卤代烃(R-X)在碱性条件下可水解得到醇(R-OH),如:CH3CH2-X+H2O 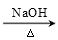 CH3CH2-OH+HR,现有如下转化关系:
CH3CH2-OH+HR,现有如下转化关系: 
回答下列问题:
(1)反应1的试剂与条件为 __________,X的结构简式为______,Y的结构简式为______;
(2)写出反应3的方程式___________________________________。