某有机物的结构简式为: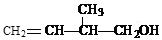
(1)该有机物中所含官能团的名称是_______________________________________;
(2)该有机物发生加聚反应后,所得产物的结构简式为_______________________;
(3)写出该有机物发生催化氧化的化学方程式(注明反应条件)_______________。
某有机物的结构简式为: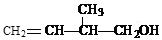
(1)该有机物中所含官能团的名称是_______________________________________;
(2)该有机物发生加聚反应后,所得产物的结构简式为_______________________;
(3)写出该有机物发生催化氧化的化学方程式(注明反应条件)_______________。