高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色非氯净水消毒剂和高容量电池材料。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下: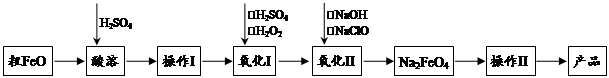
已知:NaClO不稳定,受热易分解。回答下列问题:
(1)高铁酸钠(Na2FeO4)中铁元素的化合价为 。
粗FeO酸溶过程中通入高温水蒸气,其目的是 。
(2)操作Ⅰ目的是得到高纯度FeSO4溶液,氧化Ⅰ后的溶液中如果滴加KSCN溶液,溶液变为血红色,由此推测氧化Ⅰ反应的离子方程式为 。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备:
①Cl2与NaOH溶液反应的化学方程式为_____________________________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/0C |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
| NaClO浓度/mol·L-1 |
4.6 |
5.2 |
5.4 |
5.5 |
4.5 |
3.5 |
2 |
请描述随温度变化规律:温度小于30℃时,NaClO浓度随温度升高而增大;温度高于30℃时,____________________________________________________。NaClO浓度随温度变化具有上述规律的原因为:________________________________________________________
_______________________________________________________________________________________。
 法。
法。 及一些硫酸盐。要将粗盐提纯,可先将粗盐溶解,按一定的顺序加入沉淀剂,再 ;然后将溶液调成中性并 就可以得到较为纯净的氯化钠。
及一些硫酸盐。要将粗盐提纯,可先将粗盐溶解,按一定的顺序加入沉淀剂,再 ;然后将溶液调成中性并 就可以得到较为纯净的氯化钠。 分)以石灰石、水、纯碱为原料,如何制取烧碱?写出有关反应的化学方程式,并说明基本反应类型。
分)以石灰石、水、纯碱为原料,如何制取烧碱?写出有关反应的化学方程式,并说明基本反应类型。 粤公网安备 44130202000953号
粤公网安备 44130202000953号