硫酸工业在国民经济中占有重要地位.工业制硫酸主要的生产流程如图: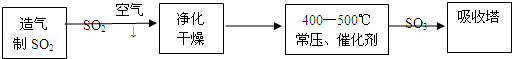
(1)工业制硫酸通常以 为原料,经造气、 、吸收三个主要生产阶段;
(2)硫酸生产的尾气中含有少量的SO2,通常用 来吸收处理;
(3)在工业生产中,反应条件有重要的作用.请回答:
①除去原料气中的有毒物质是为了防止 ;
②使用催化剂是为了提高 .
硫酸工业在国民经济中占有重要地位.工业制硫酸主要的生产流程如图:
(1)工业制硫酸通常以 为原料,经造气、 、吸收三个主要生产阶段;
(2)硫酸生产的尾气中含有少量的SO2,通常用 来吸收处理;
(3)在工业生产中,反应条件有重要的作用.请回答:
①除去原料气中的有毒物质是为了防止 ;
②使用催化剂是为了提高 .