甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)以天然气为原料制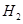 是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气
是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气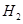 ,其反应式如下:
,其反应式如下:
①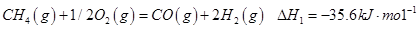
有研究认为甲烷部分氧化的机理为:
②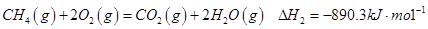
③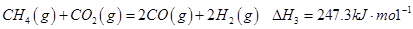
请结合以上条件写出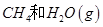 生成CO和
生成CO和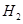 的热化学反应方程式:
的热化学反应方程式:
________________________________________________________________。
(2)恒温下,向一个2L的密闭容器中充入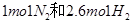 ,反应过程中对
,反应过程中对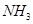 的浓度进行检测,得到的数据如下表所示:
的浓度进行检测,得到的数据如下表所示: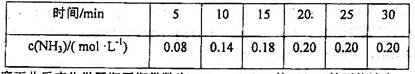
①该温度下此反应化学平衡平衡常数为________,前20min的平均速率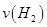 为______。
为______。
②能提高反应中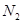 的平衡转化率的是_________。
的平衡转化率的是_________。
A.增加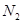 的浓度 B.增加
的浓度 B.增加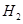 的量 C.移出部分
的量 C.移出部分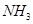 D.提高反应温度
D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
(3)下图表示合成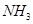 反应在某段时间
反应在某段时间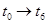 中反应速率与反应过程的曲线图,若
中反应速率与反应过程的曲线图,若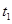 时改变的条件是升高温度,则在下列到达化学平衡的时间段中,
时改变的条件是升高温度,则在下列到达化学平衡的时间段中,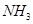 的体积分数最小的一段时间是(填写下列序号,下同)_______,化学平衡常数最大的一段时间是______。
的体积分数最小的一段时间是(填写下列序号,下同)_______,化学平衡常数最大的一段时间是______。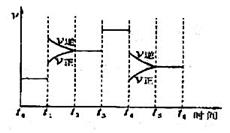
A.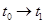 B.
B.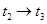
C.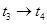 D.
D.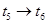
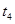 时改变的条件是_______________。
时改变的条件是_______________。
(4)如图所示,装置I为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜。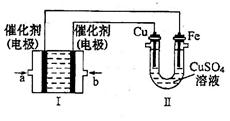
①b处电极上发生的电极反应式是___________________。
②电度结束后,装置I中溶液的pH________,装置II中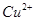 的物质的量浓度_____。(填写“变大”、“变小”或“不变”)
的物质的量浓度_____。(填写“变大”、“变小”或“不变”)
③若完全反应后,装置II中阴极质量增加12.8g,则装置I中理论上消耗氧气(标准状况下)_______L。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号