(14分)运用化学反应原理研究溶液的组成与性质具有重要意义。请回答下列问题:
(1)氨水显弱碱性,若用水稀释0.1mol·L-1的氨水,溶液中随着水量的增加而增大的是
(填写序号)
①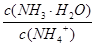 ②
②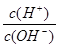 ③c(H+)和c(OH-)的乘积 ④c(H+)
③c(H+)和c(OH-)的乘积 ④c(H+)
(2)室温下,将0.01mol·L-1 NH4HSO4溶液与0.01mol·L-1烧碱溶液等体积混合,所得溶液中所有离子的物质的量浓度大小关系为 (用具体离子的浓度表达式回答)。
(3)已知:25℃时,Ksp(AgCl)=1.6×10-10(mol·L-1)2,Ksp(AgI)=1.5×10-16(mol·L-1)2。在25℃条件下,向0.1L0.002mol·L-1的NaCl溶液中逐滴加入O.1L0.002mol·L-1的AgNO3溶液,有白色沉淀生成,从难溶电解质的溶解平衡角度解释产生沉淀的原因是 ,向反应后的浑浊液中继续加入0.1L0.002mol·L-1的NaI溶液,观察到白色沉淀转化为黄色沉淀,产生该现象原因是(用离子方程式回答) 。
(4)在25℃条件下,将a mol·L-1的醋酸与b mol·L-1的烧碱溶液等体积混合(混合后体积为混合前体积之和),充分反应后所得溶液显中性。则25℃条件下所得混合溶液中醋酸的电离平衡常数为 mol·L-1(用含a、b的式子表示)。
(5)用惰性电极电解含有NaHCO3的NaCl溶液,假设电解过程中产生的气体全部 逸出,测得溶液pH变化如下图所示。则在0→t1时间内,阳极反应式为 ,溶液pH 升高比较缓慢的原因是(用离子方程式回答) 。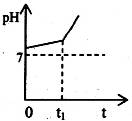


 粤公网安备 44130202000953号
粤公网安备 44130202000953号