电石中的碳化钙和水能完全反应制乙炔,使反应产生的气体排水,测量排出水的体积 ,可计算出标准状况乙炔的体积,从而可测定电石中CaC2的含量。
(1)若用下列仪器和导管组装实验装置:
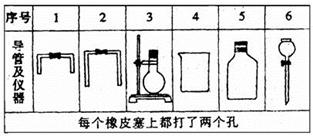 |
如果所制气流从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是 接 接 接 接 接 接 .
(2)仪器连好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。
③在仪器6和5中注入适量水。
④待仪器3恢复到室温时,量取仪器4中水的体积导管2中的水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不发生气体为止,关闭活塞。
正确的操作顺序是_____________。
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含有_______杂质。
(4)若实验时称取的电石为1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448 ml,此电石中CaC2的百分含量是_________%。

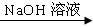 测定剩余固体质量
测定剩余固体质量

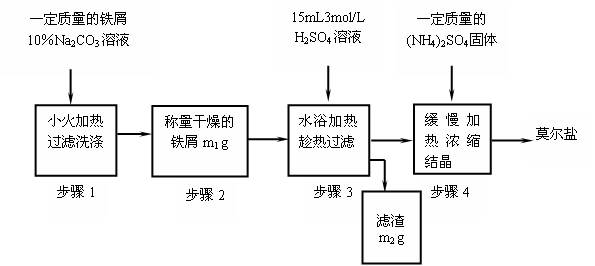
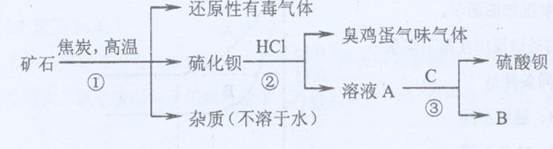 (1)写出步骤①的化学反应方程式 ,该反应产生的气体具有 、 等用途。
(1)写出步骤①的化学反应方程式 ,该反应产生的气体具有 、 等用途。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号