(6分)随着化石能源的减少,新能源的开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
①SO2(g)+I2(g)+2H2O(g)=2HI (g)+H2SO4(l) ΔH=a kJ·mol-1
②2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH=b kJ·mol-1
③2HI(g)=H2(g)+I2(g) ΔH=c kJ·mol-1
则:2H2O(g)=2H2(g)+O2(g) ΔH= kJ·mol-1
(2) 已知在101 kPa时,CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则CH4完全燃烧反应的热化学方程式是: 。
(3)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放 kJ的能量。
 CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
 2NH3(g),△H=﹣92.44kJ/mol;回答下列问题:
2NH3(g),△H=﹣92.44kJ/mol;回答下列问题: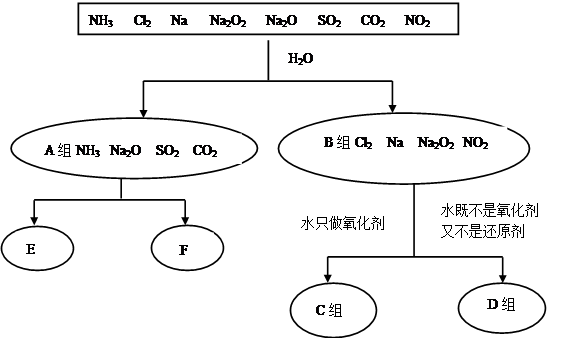
 ____Cu+____CuCl2+____N2↑+____H2O
____Cu+____CuCl2+____N2↑+____H2O 粤公网安备 44130202000953号
粤公网安备 44130202000953号