(4分)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能。下表是某些共价键的键能:
| 共价键 |
H-H |
O=O |
H-O |
| 键能/kJ ·mol-1 |
436 |
498 |
X |
根据下图中能量变化图,回答下列问题: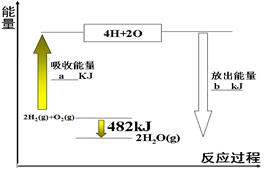
(1) 图中:a=___________。
(2) 表格中:X= 。
(4分)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能。下表是某些共价键的键能:
| 共价键 |
H-H |
O=O |
H-O |
| 键能/kJ ·mol-1 |
436 |
498 |
X |
根据下图中能量变化图,回答下列问题:
(1) 图中:a=___________。
(2) 表格中:X= 。