碱金属元素在科学研究与生产生活中有着非常广泛的用途。
(1)锂是最轻的金属,如果用锂做一架飞机,两个人就可以抬动。锂在元素周期表中的表示如图所示,填写以下空格。
①Li在元素周期表中的位置: 。
②6.941的意义: __________________________。
(2)光电管是利用碱金属铯受到光照射时能形成电流这一光电效应的性质制成的。
①完成铯的原子结构示意图: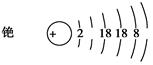
②下列有关铯的说法正确的是________。
| A.其单质在常温下与水反应不如钠剧烈, | B.其原子半径比钾原子半径小 |
| C.其氢氧化物的水溶液不能使氢氧化铝溶解, | D.其碳酸盐易溶于水 |
 电子数相同的粒子的化学式
电子数相同的粒子的化学式 
 粤公网安备 44130202000953号
粤公网安备 44130202000953号