如图所示的三个实验均可验证酸与碱能发生反应: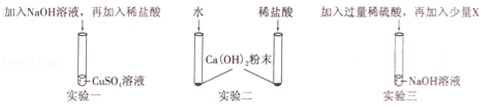
(1)根据实验一回答:
①加稀盐酸前,一定能观察到的实验现象是;
②该实验通过稀盐酸与反应的现象,验证了酸与碱能发生反应.
(2)实验二通过两只试管中的现象对比,可以判断稀盐酸与Ca(OH)2能反应,该实验除需控制所加水和稀盐酸的温度、体积相同外,还需控制相同.
(3)实验三中,加入X可验证稀硫酸与碱能发生反应,符合此条件的X是下列物质中的
| A. | 酚酞 | B. | C. | D. |
如图所示的三个实验均可验证酸与碱能发生反应:
(1)根据实验一回答:
①加稀盐酸前,一定能观察到的实验现象是;
②该实验通过稀盐酸与反应的现象,验证了酸与碱能发生反应.
(2)实验二通过两只试管中的现象对比,可以判断稀盐酸与Ca(OH)2能反应,该实验除需控制所加水和稀盐酸的温度、体积相同外,还需控制相同.
(3)实验三中,加入X可验证稀硫酸与碱能发生反应,符合此条件的X是下列物质中的
| A. | 酚酞 | B. | C. | D. |