有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0mol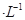 NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:
NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取l0mL原混合液,加入3.2g铜粉共热时,在标准状况下收集到气体的体积为多少升?(保留两位有效数字。)
有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0mol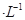 NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:
NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取l0mL原混合液,加入3.2g铜粉共热时,在标准状况下收集到气体的体积为多少升?(保留两位有效数字。)