合成氨是人类科学技术上的一项重大突破,其反应原理为:
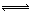
一种工业合成氨的简易流程图如下:
(1)天然气中的杂质常用常用氨水吸收,产物为。一定条件下向溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:。
(2)步骤II中制氯气原理如下:
①
②
对于反应①,一定可以提高平衡体系中百分含量,又能加快反应速率的是。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将进一步转化,可提高产量。若1 和的混合气体(的体积分数为20%)与反应,得到1.18mol 、和的混合气体,则转化率为。
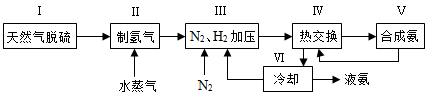
(3)下左图表示500、60.0条件下,原料气投料比与平衡时体积分数的关系。根据图中点数据计算的平衡体积分数:。
(4)依据温度对合成氨反应的影响,在下右图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,物质的量变化的曲线示意图。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号),简述本流程中提高合成氨原料总转化率的方法:。
相关知识点
 O2(g)=H2O(g) ΔH="-285.8" kJ·mol一1
O2(g)=H2O(g) ΔH="-285.8" kJ·mol一1 粤公网安备 44130202000953号
粤公网安备 44130202000953号