[化学—选修有机化学基础]A、B、C、D、E、F、G都是链状有机物,它们的转化关系如图所示,D的相对分子质量与E相差42,请回答下列问题;
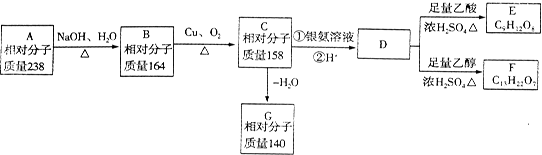
(1)D中含有的官能团是_________;D的分子式为________。
(2)D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6,请写出D的结构简式__________。
(3)写出B生成C的化学方程式___________.
(4)A只含一种官能团,则A的结构简式为___________。
(5)芳香族化合物H与G互为同分异构体,1molH与足量氢氧化钠溶液反应消耗2molNaOH,且H苯环上的一氯代物只有两种,写出符合条件的H的结构简式:______。