(7分)某化学实验室产生的废液中含有Fe3+、Cu2+、Ca2+、Cl-四种离子,为了处理废液,回收金属并制备氯化铁晶体,现设计如下实验过程(部分):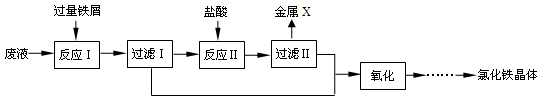
(1)金属X的化学式为 。实验室进行过滤操作除需要用到烧杯、玻璃棒和铁架台(带铁圈)外,还需要的实验用品是 。
(2)已知“反应Ⅰ”中,2FeCl3+ Fe=3FeCl2,发生的另一反应化学方程式为 ;
“反应Ⅱ”的化学方程式为 。
(3)“氧化”中,化合价发生变化的金属元素是 。
(7分)某化学实验室产生的废液中含有Fe3+、Cu2+、Ca2+、Cl-四种离子,为了处理废液,回收金属并制备氯化铁晶体,现设计如下实验过程(部分):
(1)金属X的化学式为 。实验室进行过滤操作除需要用到烧杯、玻璃棒和铁架台(带铁圈)外,还需要的实验用品是 。
(2)已知“反应Ⅰ”中,2FeCl3+ Fe=3FeCl2,发生的另一反应化学方程式为 ;
“反应Ⅱ”的化学方程式为 。
(3)“氧化”中,化合价发生变化的金属元素是 。