如下图是实验室制备SO2并验证SO2某些性质的装置图。试回答: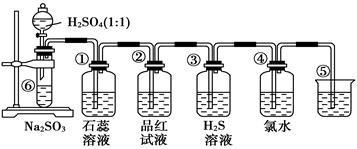
(1)⑥中发生的化学反应方程式为_____________________________。
(2)②中实验现象是 ,③中反应产物的化学式是
(3)⑤的作用是_______________ ______,反应的离子方程式为___________________。
如下图是实验室制备SO2并验证SO2某些性质的装置图。试回答:
(1)⑥中发生的化学反应方程式为_____________________________。
(2)②中实验现象是 ,③中反应产物的化学式是
(3)⑤的作用是_______________ ______,反应的离子方程式为___________________。