氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
(2)已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ΔH =" -92.4" kJ/mol
2NH3 (g) ΔH =" -92.4" kJ/mol
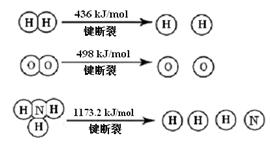
(1)计算断裂1 mol N≡N键需要能量 kJ,氮气分子中化学键比氧气分子中的化学键键 (填“强”或“弱”),因此氢气与二者反应的条件不同。
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2 (g) + O2 (g) =" 2NO" (g) ΔH =" +180.8" kJ/mol ,工业合成氨则是人工固氮。分析两种固氮反应的平衡常数,下列结论正确的是 。
反应
|
大气固氮
|
工业固氮
|
温度/℃
|
27
|
2000
|
25
|
350
|
400
|
450
|
K
|
3.84×10-31
|
0.1
|
5×108
|
1.847
|
0.507
|
0.152
|
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙两种方式分别投料(物质的量如下表)所示,发生反应:3H2 (g) + N2 (g)  2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。
|
N2
|
H2
|
NH3
|
甲
|
1
|
3
|
0
|
乙
|
0.5
|
1.5
|
1
|
①3H2 (g) + N2 (g) 2NH3 (g)的平衡常数表达式 。
2NH3 (g)的平衡常数表达式 。
②判断乙容器中反应进行的方向 。(填“正向”或“逆向”)
(4)氨气是合成硝酸的原料,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式 。
 HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的 2NH3 (g) ΔH =" -92.4" kJ/mol
2NH3 (g) ΔH =" -92.4" kJ/mol

 =________(注:题中所设单质均为最稳定单质)。
=________(注:题中所设单质均为最稳定单质)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号