(本题16分)工业上用白云石制备高纯氧化镁的工艺流程如下:
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%。
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石 。若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要 (填序号)。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图8所示。则由图示可得到的结论及原因是:
①pH过高会导致___________________________下降,其原因是_______________________
②pH过低会引起____________________________ ,其原因可能是__________(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质 B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
根据上表数据,简要说明析出CaSO4.2H2O的操作步骤是 、 。
(4)写出沉淀反应中的离子方程式: 。
(5)该生产流程中还可得到的一种副产品是_______________。
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:25℃时,
向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的
颜色为 (25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)。
| pH |
< 8.0 |
8.0 ~ 9.6 |
> 9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
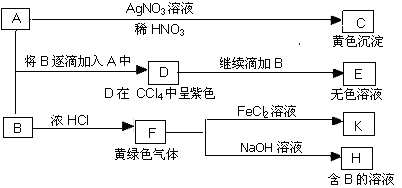
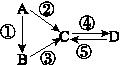
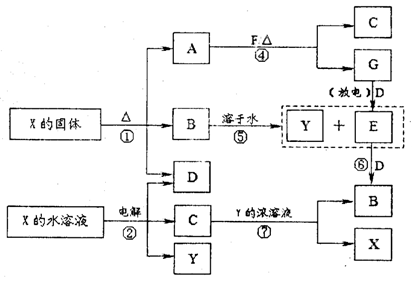
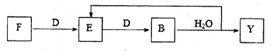
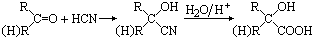 ,CO和H2按物质的量之比1∶2可以制得G,有机玻璃可按下列路线合成:
,CO和H2按物质的量之比1∶2可以制得G,有机玻璃可按下列路线合成: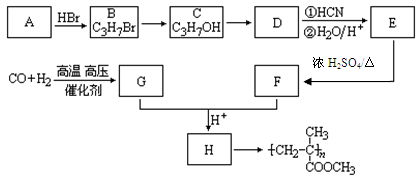
 粤公网安备 44130202000953号
粤公网安备 44130202000953号