今有化合物: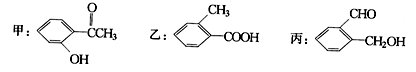
(1)请写出丙中含氧官能团的名称: 。
(2)请判别上述哪些化合物互为同分异构体: 。
(3)鉴别乙的方法(指明所选试剂及主要现象即可): 。
(4)请按酸性由强至弱排列甲、乙、丙的顺序: 。
今有化合物:
(1)请写出丙中含氧官能团的名称: 。
(2)请判别上述哪些化合物互为同分异构体: 。
(3)鉴别乙的方法(指明所选试剂及主要现象即可): 。
(4)请按酸性由强至弱排列甲、乙、丙的顺序: 。