光气()在塑料、制革、制药等工业中有许多用途,工业上采用高温下与在活性炭催化下合成。
(1)实验室常用来制备氯气的化学方程式为
(2)工业上利用天然气(主要成分为)与进行高温重整制备,已知、、和的燃烧热()分别为-890.3、-285.8和-283.0,则生成1(标准状况)所需热量为
(3)实验室中可用氯仿()与双氧水直接反应制备光气,其反应的化学方程式为
(4)的分解反应为。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10到14的浓度变化曲线未示出):
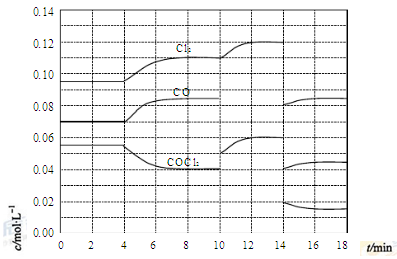
①计算反应在第8时的平衡常数=
②比较第2反应温度(2)与第8反应温度(8)的高低:(2)
(填"<"、">"或"="),
③若12时反应于温度(8)下重新达到平衡,则此时=
④比较产物在2-3、5-6和12-13时平均反应速率(平均反应速率分别以v(2-3)、v(5-6)、v(12-13))的大小
⑤比较反应物在5-6和15-16时平均反应速率的大小:v(5-6)
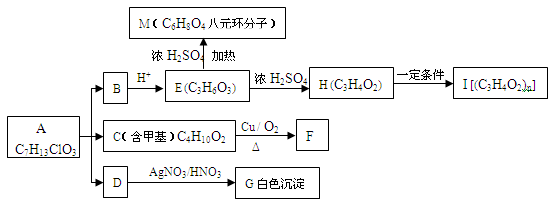
 B、C、D;
B、C、D; I;
I;
 CH3OH(g) △H1=-Q1 kJ·mol-1
CH3OH(g) △H1=-Q1 kJ·mol-1 2NH3(g)ΔH=-92.4kJ•mol-1。实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1。请回答下列问题:
2NH3(g)ΔH=-92.4kJ•mol-1。实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1。请回答下列问题:



 粤公网安备 44130202000953号
粤公网安备 44130202000953号