【物质结构与性质】
碳、氮、氧是构成生命物质的三种主要元素。
(1)碳、氮、中,原子核外电子未成对电子数最多的是 (用元素符号表示)。
(2)已知CN-与N2结构相似,则HCN分子中σ键与π键数目之比为 。
(3)H2O2分子中氧原子的杂化方式为 。
(4)与NO2+互为等电子体的微粒有 、 (举2例),NO3-的空间构型是 。
(5)已知元素A的氧化物的晶胞结构如图所示,则该氧化物的化学式为 。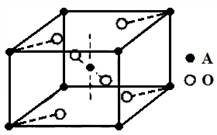
【物质结构与性质】
碳、氮、氧是构成生命物质的三种主要元素。
(1)碳、氮、中,原子核外电子未成对电子数最多的是 (用元素符号表示)。
(2)已知CN-与N2结构相似,则HCN分子中σ键与π键数目之比为 。
(3)H2O2分子中氧原子的杂化方式为 。
(4)与NO2+互为等电子体的微粒有 、 (举2例),NO3-的空间构型是 。
(5)已知元素A的氧化物的晶胞结构如图所示,则该氧化物的化学式为 。