草酸具莽有抗炎、镇痛作用,还可作为合成抗病毒和抗癌药物的中间体.莽草酸可以实现下列转化:
已知:①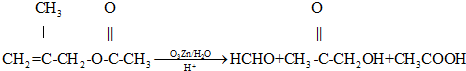
请回答下列问题;
(1)A的结构简式是 ;
(2)B→C的化学方程式是 ,反应类型是 ;
(3)在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原予称为手性碳原子.E分子中手性碳原子有 个;
(4)莽草酸经过中间产物D合成E的目的是 ;
相关知识点
草酸具莽有抗炎、镇痛作用,还可作为合成抗病毒和抗癌药物的中间体.莽草酸可以实现下列转化:
已知:①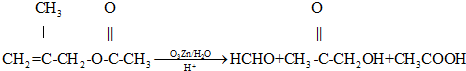
请回答下列问题;
(1)A的结构简式是 ;
(2)B→C的化学方程式是 ,反应类型是 ;
(3)在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原予称为手性碳原子.E分子中手性碳原子有 个;
(4)莽草酸经过中间产物D合成E的目的是 ;