根据下列流程回答: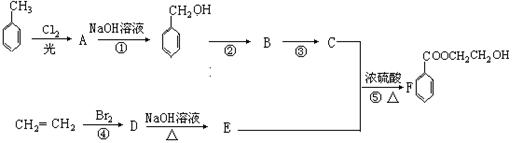
(1)写出C、E中含氧官能团的名称分别为: 、 。
(2)写出结构简式 A E
(3)在①~⑤反应中,属于取代反应的是 (填编号)。
(4)写出有关⑤的化学方程式:
根据下列流程回答:
(1)写出C、E中含氧官能团的名称分别为: 、 。
(2)写出结构简式 A E
(3)在①~⑤反应中,属于取代反应的是 (填编号)。
(4)写出有关⑤的化学方程式: