标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂和还原剂
(1) Fe2O3+3Al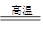 Al2O3+3Fe
Al2O3+3Fe
氧化剂是 ,还原剂是
(2)2KMnO4 + 16HCl(浓) ="==" 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
氧化剂是 ,还原剂是
标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂和还原剂
(1) Fe2O3+3Al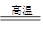 Al2O3+3Fe
Al2O3+3Fe
氧化剂是 ,还原剂是
(2)2KMnO4 + 16HCl(浓) ="==" 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
氧化剂是 ,还原剂是