(14分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素原子的核外p电子总数比s电子总数少1
|
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期
|
C原子核外所有p轨道全满或半满
|
D元素的主族序数与周期数的差为4
|
E是前四周期中电负性最小的元素
|
F在周期表的第七列
|
(1)A基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形。
(2)某同学根据上述信息,所画的B电子排布图如图

违背了原理。
(3)F位于族区,其基态原子有种运动状态。
(4)CD3 中心原子的杂化方式为,用价层电子对互斥理论推测其分子空间构型为。
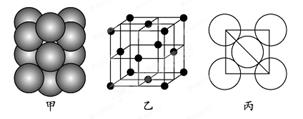
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为,该单质晶体中原子的堆积方式为四种基本堆积方式中的。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。