可逆反应:aA(g)+bB(g) cC(g)+dD(g);ΔH=Q,试根据图回答:
cC(g)+dD(g);ΔH=Q,试根据图回答: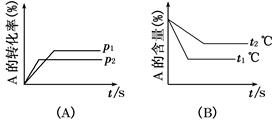
(1)压强p1比p2________(填“大”、“小”)。
(2)(a+b)比(c+d)________(填“大”、“小”)。
(3)温度t1℃比t2℃________(填“高”、“低”)。
(4)Q值是________(填“正”、“负”)。
相关知识点
可逆反应:aA(g)+bB(g) cC(g)+dD(g);ΔH=Q,试根据图回答:
cC(g)+dD(g);ΔH=Q,试根据图回答:
(1)压强p1比p2________(填“大”、“小”)。
(2)(a+b)比(c+d)________(填“大”、“小”)。
(3)温度t1℃比t2℃________(填“高”、“低”)。
(4)Q值是________(填“正”、“负”)。