科学家通过乙二醇的桥梁作用把阿司匹林连接在高聚物上,制成缓释长效阿司匹林,用于关节炎和冠心病的辅助治疗,缓释长效阿司匹林的结构简式如下: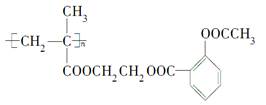
试填写以下空白:
(1)高分子载体结构简式为________。
(2)阿司匹林连接在高分子载体上的有机反应类型是________________。
(3)缓释长效阿司匹林在肠胃中变为阿司匹林的化学方程式是______________________。
科学家通过乙二醇的桥梁作用把阿司匹林连接在高聚物上,制成缓释长效阿司匹林,用于关节炎和冠心病的辅助治疗,缓释长效阿司匹林的结构简式如下: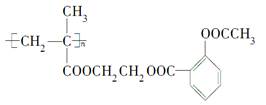
试填写以下空白:
(1)高分子载体结构简式为________。
(2)阿司匹林连接在高分子载体上的有机反应类型是________________。
(3)缓释长效阿司匹林在肠胃中变为阿司匹林的化学方程式是______________________。