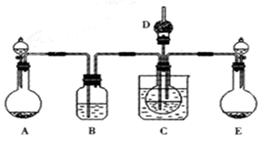
已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊。下图④中浓硫酸与木炭粉在加热条件下发生反应生成 CO2、SO2和H2O。
(1)在加热条件下,浓硫酸与木炭粉反应的化学方程式是: 。
(2)若用上图所列各装置设计一个实验,验证浓硫酸与木炭粉反应的产物,这些装置的连接顺序
(按产物气流从左至右的方向)是(填装置的编号) → → → 。
(3)B瓶溶液的作用是 。本实验中能说明二氧化硫具有漂白性的实验现象是 。③中反应的离子方程式为 。
(4)装置②中所盛是无水硫酸铜,现象是 。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号