(23分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为CO(g)+2H2(g)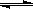 CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度
|
250°C
|
300°C
|
350°C
|
K
|
2.041
|
0.270
|
0.012
|
①由表中数据判断△H0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为,此时的温度为。
(2)在100℃压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2amol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K=(用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是。
A.升温B.加入催化剂C.增加CO的浓度D.恒容充入H2
E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同)。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
容器
|
甲
|
乙
|
丙
|
反应物投入量
|
1molCO、2moL H2
|
1molCH3OH
|
2molCH3OH
|
平衡
时的
数据
|
CH3OH浓度(mol/L)
|
c1
|
c2
|
c3
|
反应的能量变化
|
akJ
|
bkJ
|
ckJ
|
体系压强(Pa)
|
p1
|
p2
|
p3
|
反应物转化率
|
α1
|
α2
|
α3
|
请选择正确的序号填空(不定项选择)
①c1、c2、c3的关系表达正确的为
A.c3>2c1B.c1<c3<2c1 C.c1=c2
②a、b、c的关系表达正确的为
A.c<2|△H| B.a+b=|△H|C.c=2b
③p1、p2、p3的关系不正确的为
A.p1=p2 B.p2<p3<2p2C.p3>2p2
④α1、α2、α3的关系表达不正确的为
A.α1=α2 B.α3<α2C.α1+α2="1"
 2PbSO4+2H2O。
2PbSO4+2H2O。 2PbSO4+2H2O。
2PbSO4+2H2O。