如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极。电解过程中,发 现石墨电极附近先变红。请回答: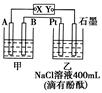
(1)电源X极为 极(填“正”或“负”),乙池中Pt电极上的电极反应式为 。
(2)甲池若为电解精炼铜的装置,其阴极增重12.8 g,则乙池中阴极上放出的气体在标准状况下的体积为 ,电路中通过的电子为 mol。
(3)在(2)的情况下,若乙池剩余溶液的体积仍为400 mL,则电解后所得溶液c(OH-)= 。
如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极。电解过程中,发 现石墨电极附近先变红。请回答:
(1)电源X极为 极(填“正”或“负”),乙池中Pt电极上的电极反应式为 。
(2)甲池若为电解精炼铜的装置,其阴极增重12.8 g,则乙池中阴极上放出的气体在标准状况下的体积为 ,电路中通过的电子为 mol。
(3)在(2)的情况下,若乙池剩余溶液的体积仍为400 mL,则电解后所得溶液c(OH-)= 。