在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示,请回答:
(1)“O”点导电能力为0的理由是 。
(2)A、B、C三点溶液c(H+)由小到大的顺序为 。
(3)若使C点溶液中c(CH3COO-)增大的同时溶液的c(H+)减小,可采取的措施是:
① ;② ;③ 。
(4)经实验测得C点处:c(CH3COOH)="0.1" mol·L-1,c(CH3COO-)="0.01" mol·L-1,则该条件下CH3COOH的电离常数Ka= 。
 主族
主族 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1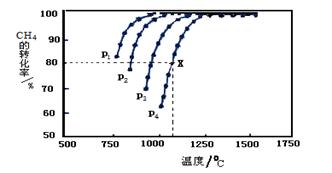
 的空间构型为________,写出与NO
的空间构型为________,写出与NO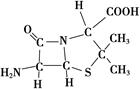
 粤公网安备 44130202000953号
粤公网安备 44130202000953号