用如图所示装置进行如下实验: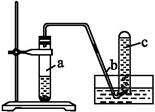
(1)在检查装置的气密性后,向试管a中加入10 mL 6 mol·L-1的稀硝酸和1 g铜片,立即用带有导管的橡皮塞塞紧试管口。请写出在试管a中有可能发生的所有反应的化学方程式 。
(2)在实验过程中常常反应开始时速率缓慢,随后逐渐加快,这是由于 ,当反应进行一段时间后速率又逐渐减慢,原因是 。
(3)欲较快地制得NO,可采取的措施是 (填写字母序号)。
| A.加热 | B.使用铜粉 | C.稀释HNO3 | D.增大硝酸的浓度 |
用如图所示装置进行如下实验:
(1)在检查装置的气密性后,向试管a中加入10 mL 6 mol·L-1的稀硝酸和1 g铜片,立即用带有导管的橡皮塞塞紧试管口。请写出在试管a中有可能发生的所有反应的化学方程式 。
(2)在实验过程中常常反应开始时速率缓慢,随后逐渐加快,这是由于 ,当反应进行一段时间后速率又逐渐减慢,原因是 。
(3)欲较快地制得NO,可采取的措施是 (填写字母序号)。
| A.加热 | B.使用铜粉 | C.稀释HNO3 | D.增大硝酸的浓度 |