玫瑰的香味物质中包含苧烯,苧烯的键线式为: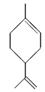
(1)1 mol苧烯最多可以跟________mol H2发生反应。
(2)写出苧烯跟等物质的量的Br2发生加成反应所得产物的可能的结构______________(用键线式表示)。
(3)有机物A是苧烯的同分异构体,分子中含有“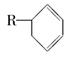 ”结构,A可能的结构为____________(用键线式表示)。
”结构,A可能的结构为____________(用键线式表示)。
(4)写出 和Cl2发生1,4加成反应的化学方程式_____________。
和Cl2发生1,4加成反应的化学方程式_____________。
玫瑰的香味物质中包含苧烯,苧烯的键线式为:
(1)1 mol苧烯最多可以跟________mol H2发生反应。
(2)写出苧烯跟等物质的量的Br2发生加成反应所得产物的可能的结构______________(用键线式表示)。
(3)有机物A是苧烯的同分异构体,分子中含有“ ”结构,A可能的结构为____________(用键线式表示)。
”结构,A可能的结构为____________(用键线式表示)。
(4)写出 和Cl2发生1,4加成反应的化学方程式_____________。
和Cl2发生1,4加成反应的化学方程式_____________。