下图中A—F均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D 为金属单质。(反应过程中水及其他产物已略去) 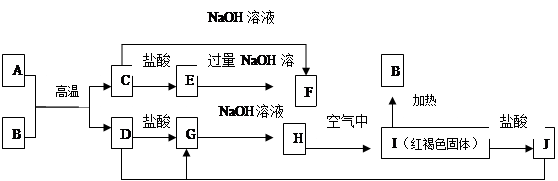
(1)C是 ,J是 (填化学式)。
(2)写出C与NaOH反应生成F的化学方程式
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的化学反应方程式 :
下图中A—F均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D 为金属单质。(反应过程中水及其他产物已略去) 
(1)C是 ,J是 (填化学式)。
(2)写出C与NaOH反应生成F的化学方程式
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的化学反应方程式 :