(1)从油脂A的结构简式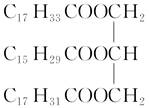 分析,它可能发生的化学反应;
分析,它可能发生的化学反应;
①从饱和性看,它能发生________反应,例如与氢气反应的化学方程式为____________________________。
②从酯的性质看,它能发生________反应,该反应的化学方程式为_______________________________。
(2)列举硬化油的性质和用途______________________________________。
(1)从油脂A的结构简式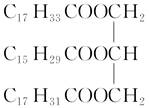 分析,它可能发生的化学反应;
分析,它可能发生的化学反应;
①从饱和性看,它能发生________反应,例如与氢气反应的化学方程式为____________________________。
②从酯的性质看,它能发生________反应,该反应的化学方程式为_______________________________。
(2)列举硬化油的性质和用途______________________________________。