下列除杂的有关操作和试剂均正确的是( )
| 组别 |
被提纯物质 |
杂质 |
除杂试剂 |
除杂操作 |
| A |
CO2 |
SO2 |
Na2CO3溶液 |
洗气 |
| B |
乙酸乙酯 |
乙酸 |
乙醇和浓H2SO4 |
加热 |
| C |
乙烷 |
乙烯 |
溴水、碱石灰 |
洗气 |
| D |
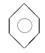 |
CH3CH2OH |
H2O |
分液 |
下列除杂的有关操作和试剂均正确的是( )
| 组别 |
被提纯物质 |
杂质 |
除杂试剂 |
除杂操作 |
| A |
CO2 |
SO2 |
Na2CO3溶液 |
洗气 |
| B |
乙酸乙酯 |
乙酸 |
乙醇和浓H2SO4 |
加热 |
| C |
乙烷 |
乙烯 |
溴水、碱石灰 |
洗气 |
| D |
 |
CH3CH2OH |
H2O |
分液 |