观察下图中物质分子的比例模型及其变化,回答下列问题。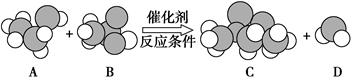
(1)A是乙醇,则B的名称是____________,
C的结构简式是____________________________。
(2)上图所示化学方程式中的“反应条件”是___________________。
(3)反应物中只有乙醇分子中的氧原子是18O,生成物中含这种氧原子的物质是(写物质名称)______________ _。
(4)在B的分子中,最外层电子数为8的原子共有________个。
观察下图中物质分子的比例模型及其变化,回答下列问题。
(1)A是乙醇,则B的名称是____________,
C的结构简式是____________________________。
(2)上图所示化学方程式中的“反应条件”是___________________。
(3)反应物中只有乙醇分子中的氧原子是18O,生成物中含这种氧原子的物质是(写物质名称)______________ _。
(4)在B的分子中,最外层电子数为8的原子共有________个。