Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 |
Mn |
Fe |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1 509 |
1 561 |
|
| I3 |
3 248 |
2 957 |
回答下列问题:
(1)Mn元素基态原子的价电子排布式为________,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是____________________________________________________________。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________;②六氰合亚铁离子[Fe(CN)64-]中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的结构式________。
(3)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。据此判断三氯化铁晶体为________。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。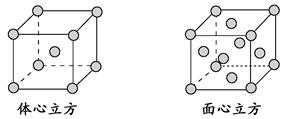
 )是食品添加剂的增香原料。
)是食品添加剂的增香原料。
 RCHO;
RCHO;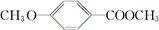 )是一种医药中间体。由茴香醛(
)是一种医药中间体。由茴香醛(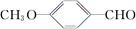 )合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)________________________。
)合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)________________________。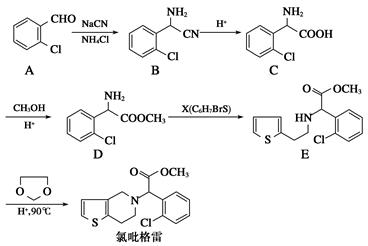
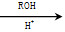 COROH
COROH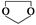 ,需要经历的反应类型有__________(填写编号)。①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有__________(填写编号)。①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物 的最后一步反应_______________________________________________。
的最后一步反应_______________________________________________。
 与
与 也可以发生类似反应①的反应,有机产物的结构简式为__________。
也可以发生类似反应①的反应,有机产物的结构简式为__________。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号