加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g·mL-1),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题。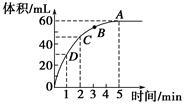
(1)A、B、C、D四点化学反应速率快慢的顺序为____________________。
(2)解释反应速率变化的原因__________________________________。
(3)计算过氧化氢的初始物质的量浓度________。
(4)求反应进行到2分钟时过氧化氢的质量分数。
加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g·mL-1),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题。
(1)A、B、C、D四点化学反应速率快慢的顺序为____________________。
(2)解释反应速率变化的原因__________________________________。
(3)计算过氧化氢的初始物质的量浓度________。
(4)求反应进行到2分钟时过氧化氢的质量分数。