已知有机物A—F具有如下的转化关系。根据要求填空:
(1)A中的含氧官能团有___________________(写名称),A的分子式为______________。
(2)A转化生成B的反应类型是_________________。
(3)C转化生成D的试剂和条件_________________。
(4)F在酸性条件下水解的化学方程式为_________________。
(5)A的同分异构体R,具有如图所示的性质。请写出符合条件的R的同分异构体的结构简式(任写两种)。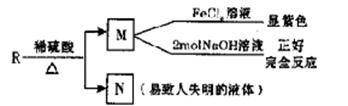
已知有机物A—F具有如下的转化关系。根据要求填空:
(1)A中的含氧官能团有___________________(写名称),A的分子式为______________。
(2)A转化生成B的反应类型是_________________。
(3)C转化生成D的试剂和条件_________________。
(4)F在酸性条件下水解的化学方程式为_________________。
(5)A的同分异构体R,具有如图所示的性质。请写出符合条件的R的同分异构体的结构简式(任写两种)。