元素周期表是学习和研究化学的重要工具。下列是元素周期表的部分信息: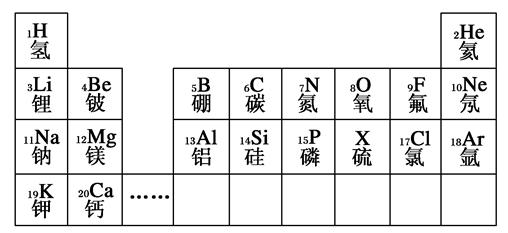
(1)地壳中含量最多的金属元素的原子序数是________。
(2)分析上表规律,可推知,表中X为________。
(3) 表示的是(写粒子符号)________。
表示的是(写粒子符号)________。
(4)写出一个由1、7、17号三种元素组成的化合物的化学式:________________________________________________________________________。
元素周期表是学习和研究化学的重要工具。下列是元素周期表的部分信息:
(1)地壳中含量最多的金属元素的原子序数是________。
(2)分析上表规律,可推知,表中X为________。
(3) 表示的是(写粒子符号)________。
表示的是(写粒子符号)________。
(4)写出一个由1、7、17号三种元素组成的化合物的化学式:________________________________________________________________________。