氯酸镁晶体[Mg(ClO3)2·6H2O]可用作棉花收获前脱叶剂、小麦催熟剂、除草剂、干燥剂。实验室制备少量Mg(ClO3)2的操作步骤如下:
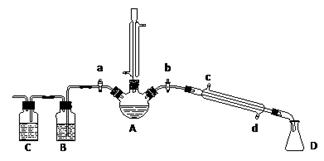
(1)制备NaClO3晶体:在实验室里可用如图所示装置制取NaClO3。图中:a为氯气发生装置;b为NaClO3的制备装置;c为尾气吸收装置。
①装置a中反应的离子方程式为____________________________
②工业上用石灰乳代替烧碱溶液吸收尾气的原因是___________________________
③装置b中发生反应的化学方程式为3Cl2+6NaOH 5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
(2)制备氯酸镁晶体:由上述提纯制得的NaClO3和MgCl2按化学反应方程式计量数之比混合可制得Mg(ClO3)2,原理为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
请补充由(1)制得的NaClO3制备Mg(ClO3)2·6H2O的操作步骤:
①按计量数之比将MgCl2和NaClO3混合溶于85 ℃的热水中,加热蒸发;
②______________________;
③______________________;
④重结晶。
(3)问题讨论:①用60 ℃ Na2CO3溶液吸收Cl2也可制得NaClO3,请写出该反应的化学方程式:__________________________________________。
②制备氯酸镁晶体时最后进行重结晶操作的目的是___________________________。


 、Pb(OH)
、Pb(OH)  ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
,各形态的浓度分数α随溶液pH变化的关系如下图所示: 
 ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, E2Pb(s)+2H+则脱铅的最合适pH范围为( )
E2Pb(s)+2H+则脱铅的最合适pH范围为( )




 粤公网安备 44130202000953号
粤公网安备 44130202000953号