下图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:
已知下列信息:
Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Cu(OH)2 |
| 开始沉淀 |
1.1 |
4.0 |
5.4 |
| 完全沉淀 |
3.2 |
5.2 |
6.7 |
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式: .。
(2)在操作Ⅱ中,x的取值范围是 。
(3)在操作Ⅲ中,蒸发浓缩需要的玻璃仪器有 。
(4)由滤渣a制取Al2(SO4)3·l8H2O,探究小组设计了三种方案:
综合考虑上述三种方案,最具可行性的是 (填序号)。
(5)为测定CuSO4·5H2O晶体的纯度,进行下列实验:取a g试样配成l00 mL溶液,每次取20.00mL,消除干扰离子后,用b mol·L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液l2.00 mL。(常温时,5%的Na2H2Y水溶液,其pH为4—6。)
①CuSO4·5H2O晶体的纯度是 。
②下列滴定方式中,最合理的是(夹持部分略去) (填序号)。

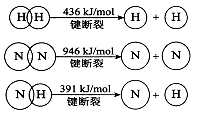
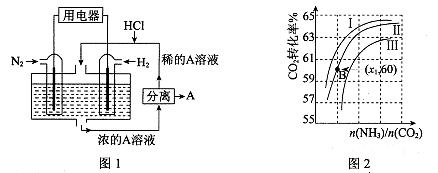
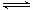 CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比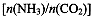 、水碳比
、水碳比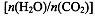 的变化关系。
的变化关系。 N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下: 浓度
浓度 H++HA-,HA-
H++HA-,HA- 粤公网安备 44130202000953号
粤公网安备 44130202000953号