700℃时,向容积为1 L的密闭容器中充入一定量的CO2和H2,发生反应:CO2+H2(g)  CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min |
n(CO2)/mol |
H2/ mol |
| 0 |
1.50 |
1.00 |
| t1 |
|
0.40 |
| t2 |
0.90 |
|
下列说法不正确的是
A.反应在t1 min内的平均速率为v(H2O)=0.60 /t1 mol·L-1·min-1
B.温度升至800℃,上述反应平衡常数为1.56,则正反应为放热反应
C.保持其他条件不变,向平衡体系中再通入1.00 molH2,与原平衡相比,达到新平衡时CO2转化率增大,H2的体积分数增大
D.保持其他条件不变,起始时向容器中充入1.00 molCO和1.50 molH2O,到达平衡时,c(CO2)=0.90 mol/L
相关知识点
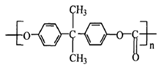
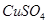 溶液,下列图示表示产生
溶液,下列图示表示产生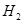 的体积(V)与时间(t)的关系,其中正确的是
的体积(V)与时间(t)的关系,其中正确的是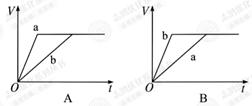
 粤公网安备 44130202000953号
粤公网安备 44130202000953号